
фото: https://www.gs1.org/industries/healthcare/udi
GS1 является органом, выпускающим стандарты UDI, что означает, что стандарты GS1 могут использоваться для соблюдения конкретных нормативных требований UDI. В настоящее время GS1 является органом, выпускающим стандарты в Европейском Союзе, Бразилии, Китае, Египте, Саудовской Аравии, Сингапуре, Южной Корее, Тайване, Турции и США. Ожидается, что в ближайшем будущем правила UDI будут опубликованы и в других странах, включая TGA Австралии.
В системе уникальной идентификации устройств (UDI) требуются два уровня информации о продукте: идентификация устройства и идентификация производства.
Идентификация устройства
Тип устройства определяется кодом, известным как идентификатор устройства (DI). В стандартах GS1 роль идентификатора устройства выполняет глобальный товарный номер (GTIN).
Идентификация производства
Динамическая информация, позволяющая идентифицировать медицинское изделие на более детальном уровне, например, серийный номер, номер партии или серии, или дата (например, срок годности). Иногда сокращается до PI, и эти производственные идентификаторы, вероятно, меняются для каждой производственной партии.
Если рассматривать эти идентификационные коды в контексте действующих правил, то они известны соответственно как UDI-DI и UDI-PI.
Уникальный идентификатор устройства (UDI)
Оговорка: Ни GS1, ни входящие в нее организации, ни их сотрудники не обладают реальными или предполагаемыми полномочиями выступать от имени регулирующих органов или предоставлять исключения.
GS1 предлагает консультационные услуги, ориентированные на стандарты GS1, после того как сотрудники поставщика, включая его внутренних экспертов по регулированию, определят правильный путь к соответствию требованиям.
GS1 — добровольная организация, и ее члены имеют и должны продолжать определять свой собственный курс действий. GS1 предоставляет рекомендации. Глобальный офис GS1, организации-члены GS1 и сотрудники GS1 не несут ответственности за действия членов, предпринятые на основании ее рекомендаций.
Что такое UDI?

Согласно Международному форуму регуляторов медицинских изделий (IMDRF), система уникальной идентификации медицинских изделий (UDI) призвана обеспечить единую, глобально согласованную систему для точной идентификации медицинских изделий на протяжении всего процесса распространения и использования. UDI требует, чтобы этикетка устройства содержала глобально уникальный идентификатор устройства, зафиксированный в носителе данных (AIDC), и если применимо - его удобочитаемый перевод (HRI) на этикетке или самом устройстве. Этот идентификатор и носитель данных должны основываться на стандартах аккредитованных органов, включая GS1. 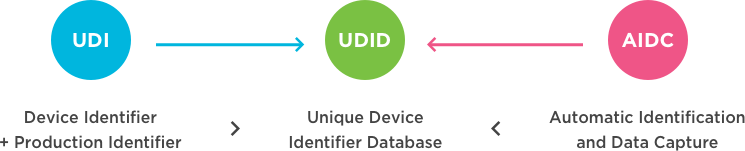
Медицинским работникам и пациентам больше не придется обращаться к многочисленным, противоречивым и неполным источникам для идентификации медицинского устройства и его ключевых характеристик. База данных уникальных идентификаторов устройств (UDID) является специализированным источником дополнительной информации.
Преимущества UDI могут быть достигнуты только в том случае, если все заинтересованные стороны, от производителя до медицинских учреждений и пациентов, будут использовать UDI во всех своих процессах и системах. Поэтому крайне важно, чтобы все заинтересованные стороны были осведомлены о разработке и использовании системы UDI.
Источник: Система уникальной идентификации устройств (UDI) IMDRF
Во всем мире различные регулирующие органы, (правительственные) учреждения и поставщики медицинских услуг стремятся к глобально согласованному внедрению UDI и делают безопасность пациентов стратегическим приоритетом.

Пікірлер
Комментарий қалдыру үшін порталға тіркеліңіз немесе кіріңіз
Авторизация через