
Специалисты из исследовательского института Скриппса во Флориде во главе с профессором и руководителем отдела неврологии института Кириллом Мартемьяновым обнаружили рецептор в мозге, блокировка которого снимает депрессию и стресс.
Рецептор клеток мозга GPR158, связанный с G-белком (GPCR), контролирует образование и функцию синапсов в мозге. Его избыток у пациентов вызывает депрессивные состояния и канцерогенез, а также нарушение когнитивных функций.
Однако структурная организация и сигнальные механизмы GPR158 в значительной степени оставались неизвестными. Теперь исследователи наконец получили представление о необычной биологии орфанных рецепторов и формировании комплексов GPCR-RGS. Авторы исследования с коллегами из университетов США, Великобритании и Индии изучили на атомном уровне структуру рецептора.
Ученые использовали одночастичную криогенную электронную микроскопию (криоЭМ) для получения структур GPR158 в апо-состоянии и в комплексе с RGS7-Gβ5 при среднем разрешении 3,4 Å и 3,3 Å соответственно. Структура демонстрирует сборку гомодимеров (двух одинаковых молекул белка, фиг. 1A), где их объединение включает внеклеточный домен, трансмембранную (TM) область и цитоплазматические элементы (фиг. 1A и фиг. S4A). Каждый протомер (единица белка) имеет заметные внеклеточные и трансмембранные домены (элемент, фолдинг которого происходит независимо), связанные гибким «стеблевым» доменом.

КриоЭМ-структуры GPR158 в его связанных состояниях апо и RGS7-Gβ5. (A) КриоЭМ-карта (слева) и модель (справа) гомодимера GPR158 в ленточном представлении с протомерами, окрашенными в голубой и розовый цвет. Фосфолипиды PE и PI и холестерины показаны зеленым, синим и желтым цветами соответственно. (B) КриоЭМ-карта (слева) и модель (справа) гомодимера GPR158 в комплексе с RGS7-Gβ5 в ленточном представлении, окрашенном как (A), а RGS7 и Gβ5 показаны темно-оливковым и коричневым цветом.
Исследователи обнаружили, что в связанном состоянии RGS7 плотность эктодомена GPR158 становится диффузной. Эта более высокая конформационная гибкость в эктодомене, возможно, индуцированная связыванием RGS7-Gβ5, предполагает, что внеклеточные и внутриклеточные элементы комплекса могут быть аллостерически связаны, что активирует и, наоборот, снижает активность белка. Такое представление дополнительно подтверждается трехмерным анализом вариабельности, который показал, что волны ECD (электронозахватного детектора) совпадают со связыванием RGS7-Gβ5.
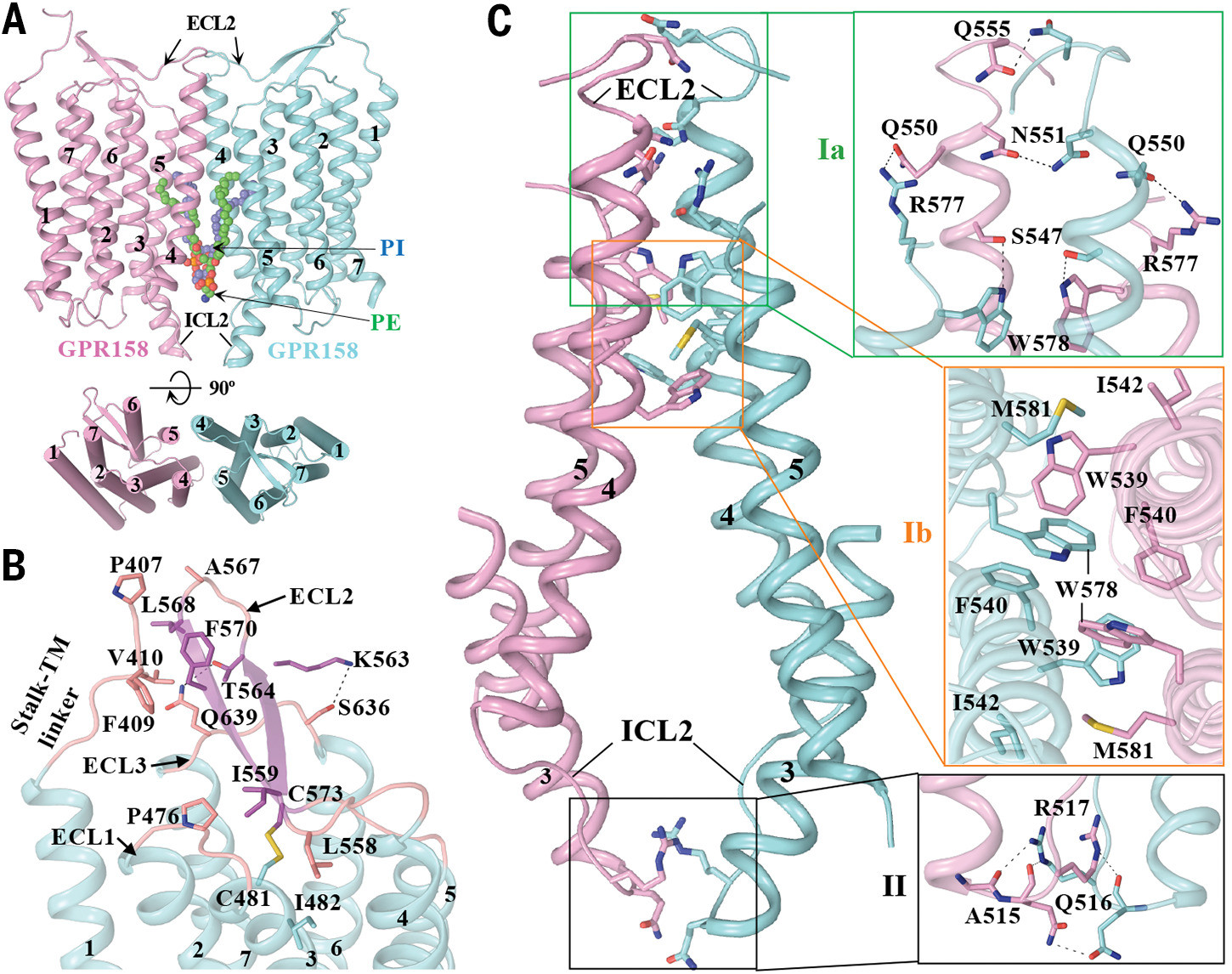
Организация трансмембранного домена GPR158 и его гомодимерного интерфейса. (A) Общее расположение области 7TM протомеров GPR158 показано сбоку и сверху. Фосфолипиды PE и PI идентифицируются в полости, образованной димерным интерфейсом TM, в виде сфер. Протомеры и фосфолипиды 7TM окрашены, как на рис. 1. (B) Увеличенный вид области внеклеточной петли. ECL2 закрывает внеклеточный карман, взаимодействуя с остатками TM3, ECL1 и ECL3. ECL2 C573 сохраняет консервативную дисульфидную связь с TM3 C481. ECL2 также стабилизируется за счет взаимодействия с линкером stalk-TM, который соединяет эктодомен с 7TM. (C) Интерфейс димера 7TM формируется на двух участках (I и II), на внеклеточной и внутриклеточной стороне. Прямые контакты на внеклеточной стороне образованы TM4, TM5 и ECL2 обоих протомеров. Внутриклеточный боковой интерфейс образован TM3 и ICL2 обоих протомеров.
Для дальнейшего изучения конформационной динамики ученые провели биохимические эксперименты. Они изучили влияние связывания с синтетическим C-концевым пептидом, который включает модуль CT-CC, с помощью гель-фильтрации. Образования комплекса с этим пептидом было достаточно, чтобы вызвать большое изменение гидродинамического поведения RGS7-Gβ5, согласующееся со значительными изменениями в RGS7-Gβ5 при связывании с GPR158.
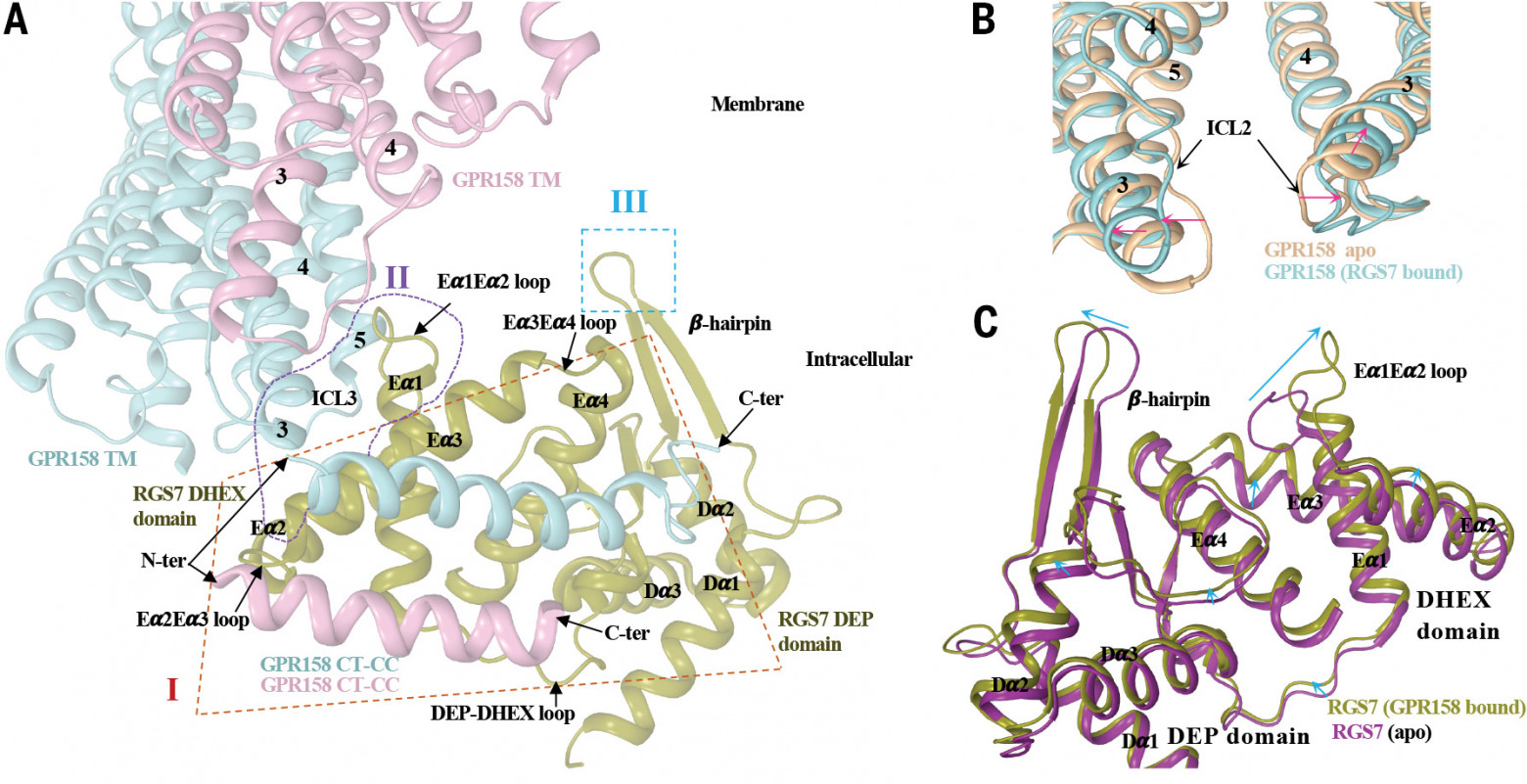
Механизм взаимодействия GPR158 с RGS7. (A) RGS7 образует два различных сайта связывания (I и II) на GPR158, оба созданы димеризацией GPR158. Первый интерфейс связывания формируется между GPR158 CT-CC и RGS7 DEP-DHEX. Второй интерфейс образован GPR158 7TM и RGS7 DHEX. Кроме того, β-шпильочная петля RGS7 вставляется в мембрану (обозначена как III) и может способствовать ориентации RGS7 по направлению к мембране. (B и C) Конформационная перегруппировка на димерном интерфейсе GPR158 TM и RGS7 при образовании комплекса. TM3 одного протомера смещается к ядру 7TM, отделяя его от другого протомера, чтобы разместить RGS7 на границе раздела (B). Большой сдвиг конформации в петле Eα1Eα2 домена RGS7 DHEX наряду с перестройкой петли β-шпильки и спиралей, которые смещаются вверх по направлению к мембране (C).
В своей работе исследователи представили структуры с высоким разрешением необычной рецепторной сборки, которая включает GPCR в комплексе с регулятором передачи сигналов — белком RGS. Белок RGS связывает те же элементы, которые GPCR используют для взаимодействия с их преобразователями сигнала: G-белки и β-аррестины.
Авторы работы предположили, что связывание лиганда (молекулы, связанной с центром) с внеклеточным ECD будет активировать GPR158 перестройку цитоплазматических доменов, которые задействуют RGS, чтобы изменить его активность. Учитывая, что связывание RGS препятствует канонической активации G-белков GPR158, его можно описать как рецептор, связанный с RGS.
Также ученые показали роль двух фосфолипидов в организации интерфейса димеризации GPCR. Эти липиды скрепляют протомеры и дают возможности для модуляции GPCR. Исследователи надеются, что их открытия будут стимулировать дальнейший прогресс в понимании регуляторных и сигнальных механизмов GPR158, облегчая поиск его лигандов. По мнению ученых. эта работа позволит представить терапевтические средства для лечения депрессии, основанные на блокировке GPR158.
В сентябре СМИ сообщили, что в Великобритании женщину с тяжелой формой депрессии успешно вылечили с помощью экспериментального мозгового имплантата. Данное устройство работает, обнаруживая паттерны мозговой активности, связанные с депрессией, и автоматически прерывает их с помощью крошечных импульсов электрической стимуляции. Это первая демонстрация того, что активность мозга, лежащая в основе симптомов психического заболевания, может быть обнаружена и блокирована, а пациент может вернуться к нормальной жизни, даже если болел в течение многих лет.

Комментарии
Чтобы оставить комментарий зарегистрируйтесь или войдите
Авторизация через